„Sprunggene“ sind zwar nicht der neueste Tanztrend, aber sie könnten der Schlüssel zu einem besseren Verständnis des Alterns sein. Ein Forscherteam untersuchte, wie diese DNA-Segmente, die für ihre Fähigkeit bekannt sind, von einem Teil des Genoms zum anderen zu „springen“, die Langlebigkeit beeinflussen. Und die Ergebnisse? Überraschend.
Die Forschung hinter den Hopping-Genen
Die transponierbare Elemente (TE), auch bekannt als Transposons oder „springende Gene“ sind DNA-Sequenzen, die sich von einer Stelle im Genom zu einer anderen bewegen oder springen. Diese Bewegungen können manchmal zu Mutationen am neuen Standort führen, was zu einer Art genomischer Instabilität führt, die zum Altern führt. Können sie blockiert werden?
Die Forscher des Eötvös-Loránd-Universität (ELTE) In Ungarn hatte man bereits 2015 und 2017 Studien veröffentlicht, in denen man theoretisierte, wie ein bestimmter Prozess abläuft Piwi-piRNA, trug zum Altern bei, indem es dazu beitrug, transponierbare Elemente zu kontrollieren. Mit ihrer neuesten Studie liefern sie nun den experimentellen Beweis, wie dieser Prozess funktioniert.
Piwi-piRNA, für Freunde „P-Element-induzierter schwacher Hoden im Drosophila-Piwi-interagierenden RNA-Weg“, ist ein spezifischer RNA-Silencing-Mechanismus, der Genome vor der nachteiligen mutagenen Aktivität von TEs schützt. Und es erweist sich als wirklich vielversprechend.
Das Experiment und seine Entdeckungen

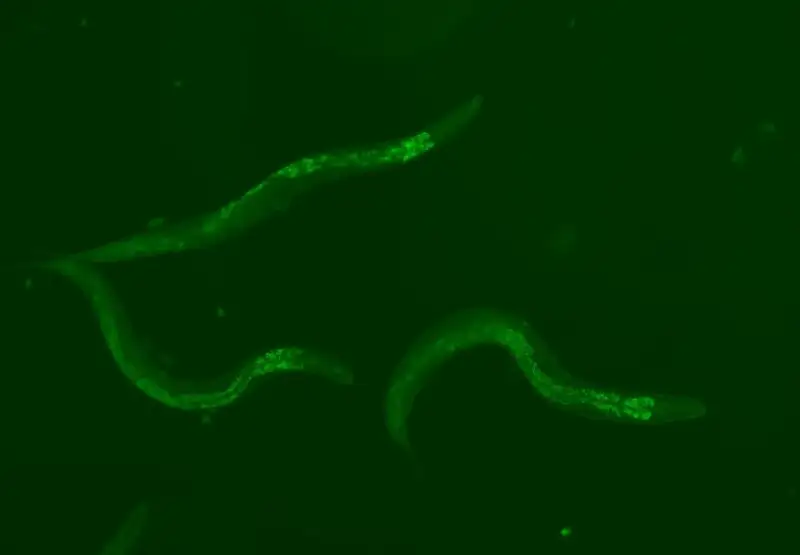
In der neuesten Studie, veröffentlicht in der Zeitschrift Nature Communications veröffentlicht (Ich verlinke es hier) Ungarische Forscher führten Experimente durch Caenorhabditis elegans. Es handelt sich um einen kleinen Wurm, der häufig als Modell für Studien zum Alter, zu altersbedingten Krankheiten und Langlebigkeitsmechanismen verwendet wird: Der Grund dafür ist, dass er Homologe (in der Reihenfolge ähnliche Gene) von etwa zwei Dritteln aller menschlichen Krankheitsgene aufweist.
Durch die Reduzierung der Aktivität von „springenden Gen“-Familien stellten die Forscher fest, dass die Reduzierung zweier spezifischer Familien, Tc1 und Tc3, die mobilsten TEs im Wurm, verlangsamten den Alterungsprozess bei verschiedenen Temperaturen. Bei durchschnittlich 20 °C verlängerte sich die Lebensdauer um ca. 10 %. Durch die gleichzeitige Reduzierung beider Genfamilien werden die lebensverlängernden Effekte nahezu verdoppelt. Die Reduzierung anderer TE-Familien – Tc2, Tc4 und Tc5 – hatte keinen erkennbaren Einfluss auf die Lebensdauer.
Zukünftige Auswirkungen und medizinische Anwendungen
„Bei unseren Tests konnten wir einen deutlichen Vorteil hinsichtlich der Lebensdauer beobachten“, bestätigt er Adam Sturm, Hauptautor der Studie. „Dies öffnet die Tür zu unzähligen möglichen Anwendungen in der Welt der Medizin und Biologie.“
Das ist noch nicht alles: Die Forscher fanden mit zunehmendem Alter epigenetische Veränderungen in der DNA dieser Würmer und in den „springenden Genen“. Und sie gehen davon aus, dass die Analyse dieser Veränderungen eine genaue Methode zur Bestimmung des biologischen Alters sein könnte (dies wird jedoch Gegenstand neuer Forschung sein).
Ein besseres Verständnis der Wege, die das Altern kontrollieren, könnte dazu führen, Wege zu finden, das Leben zu verlängern und die Gesundheit in unseren späteren Jahren zu verbessern, sagen Forscher. Wir warten und hoffen: Lebe lange und gedeihe!


