Ein Team von Bioingenieuren des Georgia Institute of Technology erweitert die Präzision und Leistungsfähigkeit der Therapie, die bereits die Onkologie revolutioniert.
Die CAR-T-Zelltherapie wird von Patienten, klinischen Forschern, Investoren und den Medien als außergewöhnliches Heilmittel für bestimmte Krebsarten gefeiert.
Woraus die CAR-T-Therapie besteht
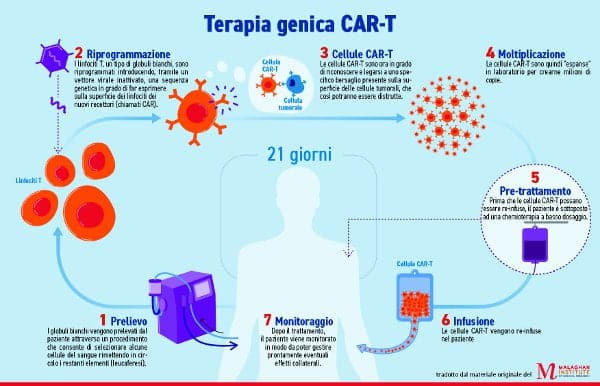
Die Therapie besteht darin, die T-Zellen eines Patienten, eine Art von weißen Blutkörperchen, im Labor zu entwickeln. Anschließend wird ein chimärer Antigenrezeptor (CAR) hinzugefügt und schließlich werden die „personalisierten“ CAR-T-Immunzellen in den Körper des Patienten zurückgeführt, wo sie nach Krebszellen suchen und diese zerstören. So funktioniert es, wenn es funktioniert.
Es ist ein neues, sich entwickelndes und boomendes Gebiet der Immuntherapie. Inzwischen gibt es weltweit über 500 klinische Studien, in denen CAR-T-Zellen zur Behandlung von Krebs untersucht werden.
CAR-T: für viele, aber nicht für alle
Die CAR-T-Therapie hat sich bei Patienten mit im Blut zirkulierenden flüssigen Krebserkrankungen wie Leukämie als sehr wirksam erwiesen
Gabe Kwong, Department of Biomedical Engineering an der Georgia Tech and Emory.
Leider funktionieren CAR-Ts bei soliden Tumoren (Sarkomen, Karzinomen) aus mehreren Gründen nicht gut. Ein großes Problem ist, dass CAR-T-Zellen durch die Tumormikroumgebung immunsupprimiert werden.
Kwong und Kollegen nehmen einige zelluläre Veränderungen vor, um die Art und Weise zu verbessern, wie CAR-T-Zellen Krebs bekämpfen. Sie fügten den Zellen einen "on-off genetischen Schalter" hinzu und entwickelten ein Fernsteuerungssystem, das die modifizierten T-Zellen auf "Präzisionsmissionen" in die Tumormikroumgebung schickt, wo sie den Tumor abtöten und ein Wiederauftreten verhindern.

Das Team illustrierte die neue Methode in einer Studie kürzlich in der Zeitschrift Nature Biomedical Engineering veröffentlicht.
Die neueste Studie
Kwong und Kollegen untersuchen die Möglichkeit der Fernsteuerung von Zelltherapien. Eine Möglichkeit, mit Präzision auf die Tumorenwo immer sie im Körper sind. Mögen? Aktivierung von CAR-T-Zellen mit Wärme wenn sie sich bereits in den Tumoren befinden, um die Probleme der Immunsuppression zu überwinden.
In einem Maustest strahlten die Forscher Laserpulse von außerhalb des Körpers des Tieres auf den Tumor ein. In den Tumorbereich injizierte Goldnanoröhren wandelten die Lichtwellen in lokalisierte Wärme um, wodurch die Temperatur auf 40-42 Grad Celsius (104-107,6 F) angehoben wurde. Das reicht aus, um den CAR-T-Zellschalter zu aktivieren, aber nicht so heiß, dass es GESUNDES Gewebe oder die CAR-T-Zellen selbst schädigen würde.
Sobald sie "angeschaltet" sind, beginnen CAR-T-Zellen ihre Arbeit zu tun und erhöhen die Expression von krebsbekämpfenden Proteinen.

Ein unglaubliches genetisches Upgrade
Die eigentliche Neuheit dieser Studie, sagt Kwong, ist die Gentechnik, die auf CAR-T-Zellen angewendet wird. Harte Arbeit, die die letzten drei Jahre gedauert hat.
CAR-T-Zellen haben jetzt einen "Schalter", der auf Hitze und andere Verbesserungen reagiert: Sie wurden buchstäblich "umverdrahtet", um Moleküle zu produzieren, die das Immunsystem stimulieren. Und sie nur dort zu produzieren, wo sie gebraucht werden.
Diese krebsbekämpfenden Proteine sind wirklich wirksam, aber sie sind zu toxisch, um systemisch verabreicht zu werden. Mit unserem Ansatz erhalten wir alle Vorteile ohne die Nachteile.
Gabe Kwong
Die Ergebnisse? Außerordentlich
Die neueste Studie zeigt, dass die CAR-T-Therapie Krebs bei Mäusen heilt. Der Ansatz des Teams tötete nicht nur die Tumore, sondern verhinderte auch Rückfälle, was für das langfristige Überleben entscheidend ist.
Weitere Studien werden sich weiter mit der Personalisierung von CAR-T-Zellen und der Wärmeabstrahlung in den Tumorbereich befassen.
„Beim Menschen werden wir fokussierten Ultraschall verwenden, der absolut nicht-invasiv ist und in der Lage ist, jede Stelle im Körper anzuvisieren“, sagt Kwong. „Eine der Einschränkungen des Lasers besteht darin, dass er nicht sehr weit in den Körper eindringt. Bei tiefer Malignität ist dies ein Problem. Wir wollen die Probleme beseitigen“.